在现如今的快节奏生活中,熬夜晚睡已经成为当代“搬砖人”的生活标签。“报复性熬夜”、“朋克养生”、“越晚越嗨”等已经是老生常谈的话题了。社会的压力和忙碌的工作告诉我们,熬最长的夜,缺最多的觉,睡不够就对了。
然而,科学家告诉你,熬夜促炎伤脑!
近日,北京大学第六人民医院的陆林院士研究团队在《自然》的旗下子刊Molecular Psychiatry发表重要研究成果,他们发现睡眠剥夺(SD)引起肠道菌群紊乱,促进炎症信号通路TLR4/NF-κB的激活,诱导中枢神经炎症及小胶质细胞的活化,最终导致认知功能受损[1]。

论文首页截图
睡眠剥夺影响着世界数百万人的身心健康,良好的睡眠可以改善人的认知功能,提高工作效率,相反,睡眠不足或睡眠作息不规律则会损害认知功能,注意力涣散[2]。此外,睡眠不足也会增加罹患神经精神性、代谢性、炎症性等疾病的风险[3,4]。睡眠剥夺可以导致中枢和外周免疫炎症反应的激活,释放相关促炎细胞因子,引起神经功能受损,但其中的具体调节机制还不清楚。
近年来,多项研究表明,肠道菌群调节宿主免疫应答,与认知功能和多种神经精神性疾病密切相关[5,6]。肠道菌群代谢产物短链脂肪酸(SCFAs)是肠脑轴的重要媒介,具有维持肠道免疫功能,保护肠屏障通透性的作用[7]。
已有研究表明,SCFAs可以抑制脂多糖(LPS)和巨噬细胞相关的炎症细胞因子如TNFα、IL-6等的释放[8]。除此之外,SCFAs还影响中枢小胶质细胞的成熟和分化,调节中枢神经炎症的发展[9]。
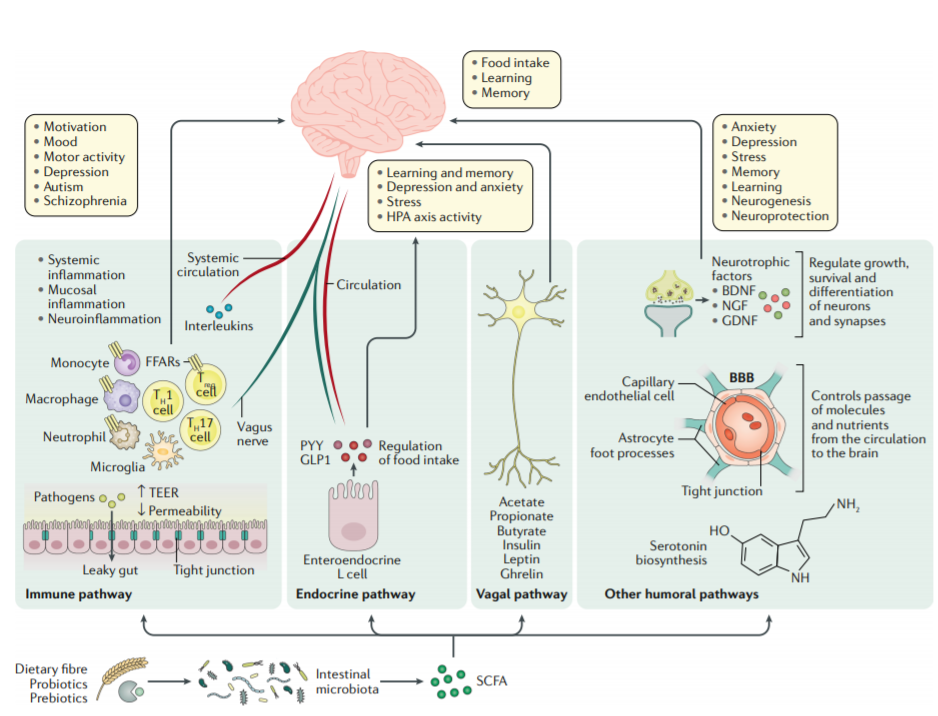
肠道菌群及其代谢产物SCFAs对神经功能的调节通路
睡眠障碍可以导致肠道菌群紊乱[10],但肠道微生物失调仅仅只是睡眠障碍的不良后果之一吗?还是作为媒介,调节睡眠剥夺后的对身体造成的一系列不良影响呢?肠道菌群与睡眠障碍之间的因果关系是怎样的呢?
为了回答这一问题,研究团队在临床实验和动物实验中探讨了睡眠剥夺对肠道菌群的影响,并进一步研究了肠道菌群紊乱对睡眠剥夺后免疫炎症反应和认知功能损害的调节机制。
首先,让我们来看看临床实验部分是怎么开展的。
研究人员招募了25名健康参与者,年龄在19-24岁之间,这些参与者在过去6个月保持规律的作息时间,以减小先前睡眠不足对研究结果的影响(睡觉时间11:00 PM ±30 min,起床时间7:00 AM ±30min)。
在正式实验之前,所有的参与者通过佩戴手腕式睡眠监测仪,记录1周的睡眠作息时间。之后参与者被要求在呼吸睡眠监测中心(北大第六人民医院)适应2天,每晚维持8小时的睡眠时间,适应期过后,每名参与者执行长达40小时的睡眠剥夺(SD),再恢复8小时的睡眠时长(RS)。期间收集参与者基线时、SD24小时、SD40小时的空腹血标本及大便标本。
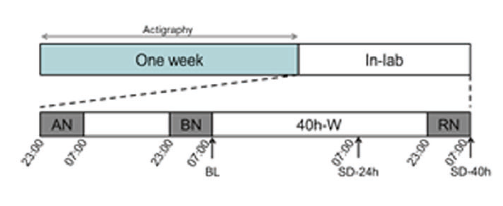
睡眠剥夺临床试验流程图
研究人员发现,相对于基线水平而言,SD后参与者的注意力及警觉性变差,蒙特利尔认知评估量表(MoCA)总分下降,其中记忆领域的评分受影响最大。由于睡眠剥夺对神经内分泌存在影响,研究人员也检测了参与者的血清皮质醇水平,发现SD后明显增高,说明睡眠剥夺影响下丘脑-垂体-肾上腺轴(HPA轴)。
先前有研究报道急性睡眠缺失可以诱导外周循环中NK-κB信号通路迅速激活[11]。研究人员也检测了参与者的血清炎性细胞因子的表达水平,发现睡眠剥夺后TNF-α、IL-1β、IL-6等促炎因子水平增加,而抗炎因子IL-10表达水平降低。
LPS可以作用于血清脂多糖结合蛋白(LBP)和CD14蛋白,激活细胞表面受体TLR4,导致NF-κB转录因子激活,释放促炎细胞因子TNF-α、IL-1β、IL-6,加剧机体炎症反应[12]。
为了证实LPS/TLR4信号通路的激活,研究人员检测了SD后参与者血清中TLR4信号通路的相关分子,发现相对于基线水平,SD后参与者血清中LBP和LBP/CD14的比值增加。这说明SD导致认知功能受损,外周炎症反应加剧。
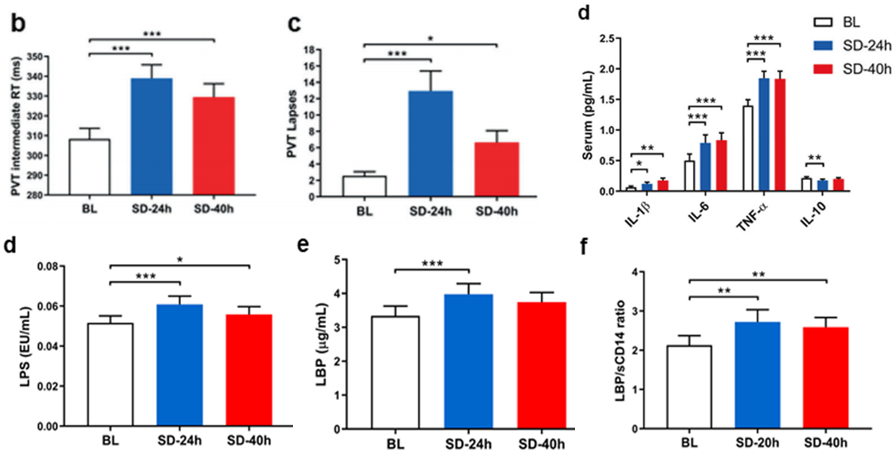
睡眠剥夺后参与者的精神运动警觉性测试(PVT)及循环中免疫炎症反应
那睡眠剥夺对肠道菌群及其代谢产物的影响又是怎样的呢?
研究人员将收集的基线、SD后24小时、SD后40小时的大便标本做16srRNA测序发现:SD后的肠道菌群α多样性明显下降;采用主坐标分析(PCoA)不同时间点样本间的肠道菌群结构差异。
结果发现SD前后样本间UniFrac距离较远,说明与基线相比,SD后参与者的肠道菌群组成发生改变;进一步通过线性判别分析发现,在菌属水平上,SD后参与者体内的SCFAs相关肠道菌群的相对丰度明显下调,包括Alloprevotella、Allobaculum、Elusimicrobium、Prevotella。
质谱分析进一步证实SD后参与者大便标本中的乙酸、丙酸、丁酸水平下降。
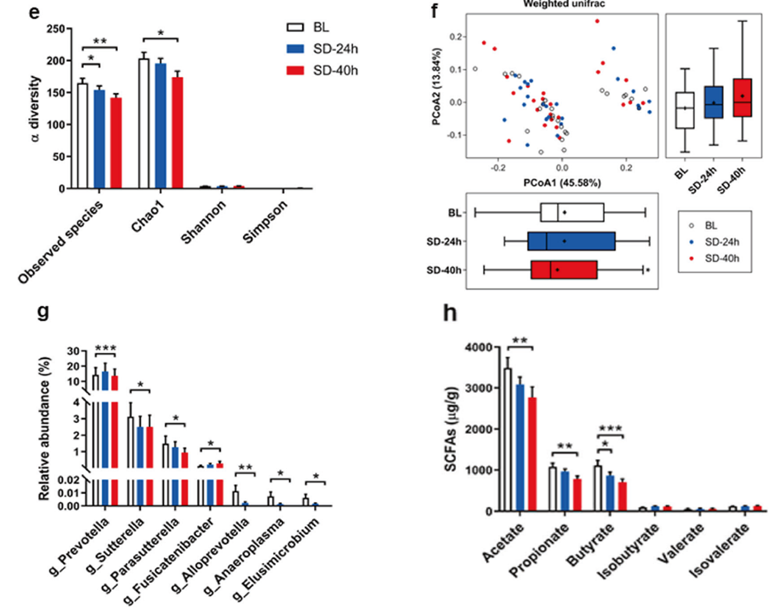
睡眠剥夺前后的肠道菌群及代谢产物SCFAs的变化
由于肠道屏障介导了肠道菌群与免疫系统的互作,那睡眠剥夺是否对屏障功能存在影响呢?
研究人员检测了参与者血清连蛋白和S100β的表达水平(前者为肠屏障通透性的标志物,后者为血脑屏障的标志物),发现睡眠剥夺后两者的表达都明显升高了。因此,睡眠剥夺可以导致肠道菌群紊乱,SCFAs浓度减少,并且破坏生理屏障功能。
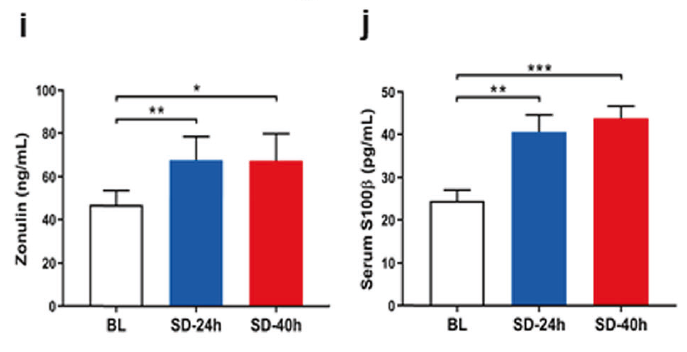
睡眠剥夺后肠屏障及血脑屏障相关标志物的表达水平变化
既然肠道菌群可以调节免疫炎症反应,而睡眠剥夺又与炎症激活相关,那肠道菌群是否可以调节SD后免疫炎症反应,导致认知功能受损呢?
与常规饲养的无特定病原体小鼠(SPF)相比,无菌小鼠(GF)的肠道菌群缺失,是研究肠道菌群功能和作用的重要工具。在动物实验中,研究人员采用GF小鼠和SPF小鼠两种模型,随机分为SD组和对照组。在SD组,小鼠经历长达24小时的睡眠剥夺,再恢复3小时睡眠。
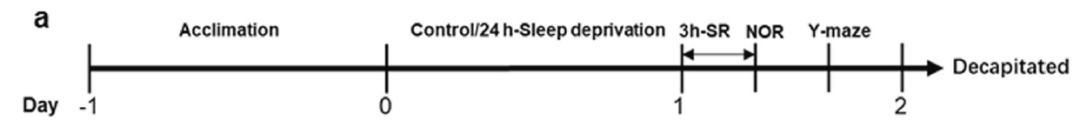
小鼠睡眠剥夺及行为测试试验流程图
与临床实验结果一致的是,SD可以增加SPF鼠和GF鼠的血清皮质醇水平。
在SPF小鼠中,SD处理后可导致炎症因子TNFα、IL-1β、IL-6表达水平明显增加,IL-10水平下降,而GF小鼠在SD后的炎症因子表达水平未见明显变化,这说明SD诱导的免疫炎症反应在肠道菌群缺失的情况下会减弱。
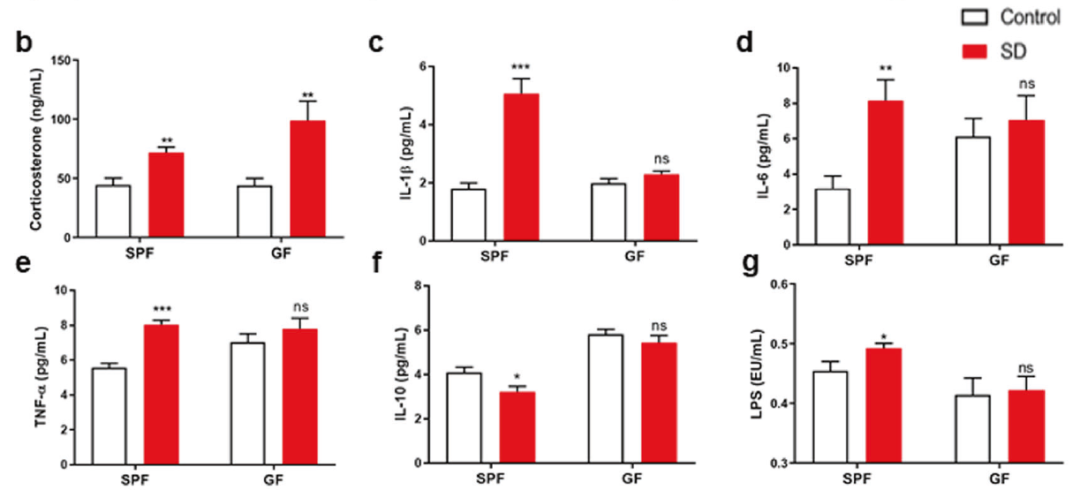
GF小鼠和SPF小鼠在睡眠剥夺后的皮质醇水平及免疫炎症反应的变化
完整的肠屏障可以防止微生物入侵,抑制肠道菌群对免疫炎症反应的激活。在SPF小鼠中,肠屏障通透性标志物Muc2和PAS+杯状细胞在SD处理后明显减少,而在GF小鼠中,SD处理后肠屏障功能无明显变化,同时血脑屏障的标志物S100β也有类似的变化。
接着研究人员利用新事物识别实验(NOR)和Y型迷宫实验评估小鼠的认知功能。他们发现SD可以使得SPF小鼠表现出更差的空间记忆功能,而对GF小鼠的认知功能无明显影响。以上结果说明:肠道菌群在SD诱导的炎症反应和认知损伤中起着重要的调节作用。
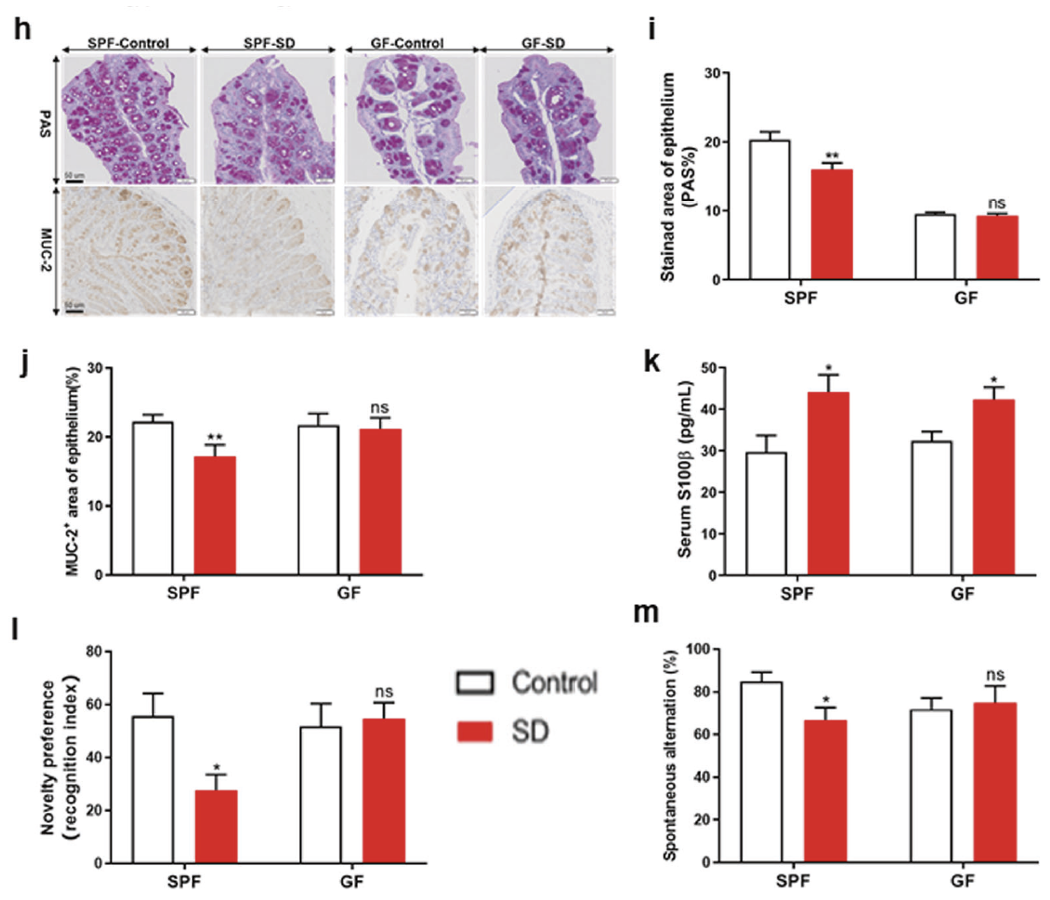
GF小鼠和SPF小鼠在睡眠剥夺后的生理屏障改变及行为学测试
那睡眠剥夺诱导的肠道菌群紊乱究竟是怎样调节免疫炎症反应,使认知功能受损的呢?
为了探讨SD诱导的肠道菌群紊乱对炎症反应的调节作用,研究人员最后对无菌小鼠进行了粪菌移植实验(FMT)。将参与者基线时的粪菌和SD40小时后的粪菌分别移植给GF小鼠,持续2周后评估两组小鼠的炎症反应状态。
与移植基线时粪菌的小鼠(rBL)相比,来源于SD40小时后的粪菌使受体小鼠(rSD)的TNGα、IL-1β、IL-6表达明显上调,IL-10水平下调,同时血清皮质醇水平和内毒素水平也增加,TLR4和磷酸化NK-κB p65的表达增多,肠屏障破坏更为严重。
这说明移植SD后的粪菌可以激活TLR4/NF-κB炎症信号通路,增加肠屏障通透性。
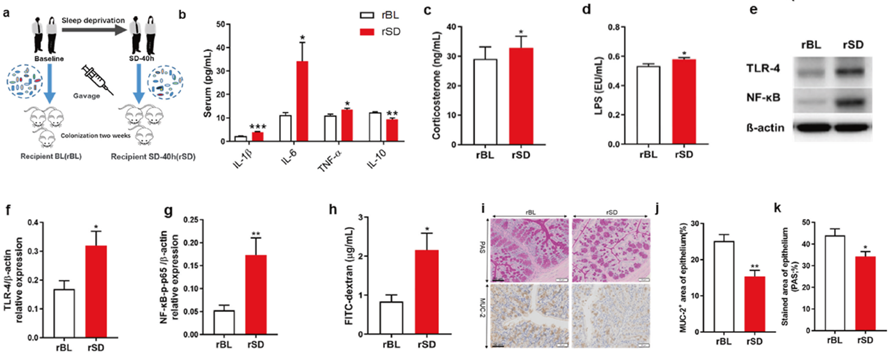
粪菌移植试验流程图及不同组别小鼠的免疫炎症反应及生理屏障的差异
最后,由于睡眠剥夺影响多个大脑区域的功能,包括海马(HPC)和内侧额叶皮质区(mPFC),这些脑区域与认知功能密切相关。相比于rBL组,rSD组的HPC和mPFC组织中IL-1β、IL-6水平更高,而IL-10水平更低,并且Iba1+细胞数量在HPC和mPFC区域也较多,说明来源于SD的粪菌促进小胶质细胞活化。
研究人员再次利用新事物识别实验(NOR)和Y型迷宫实验评估小鼠认知功能,发现rSD组的小鼠记忆功能表现更差。这说明睡眠剥夺诱导的肠道菌群紊乱,可以调节中枢小胶质细胞活化及外周TLG4/NF-κB免疫炎症信号通路的激活,影响认知功能。
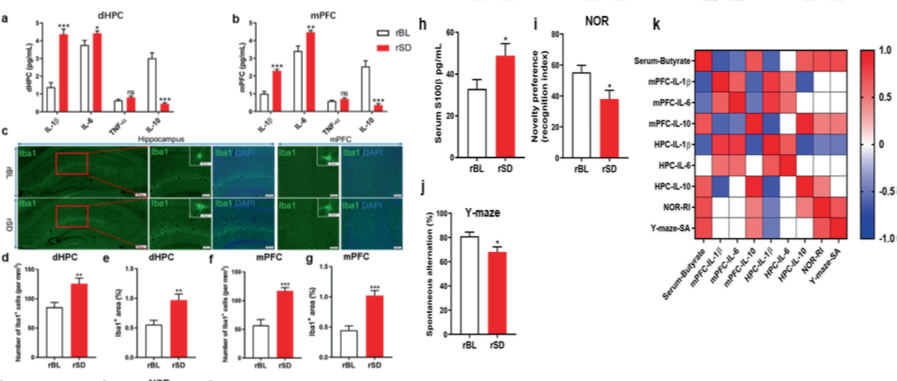
移植基线时的粪菌和SD40小时后的粪菌对受体小鼠的中枢神经炎症及认知功能的影响
总的来说,研究人员完成了睡眠剥夺损害认知功能的机制探索,证实了睡眠剥夺与肠道菌群之间的因果联系——睡眠剥夺诱导肠道菌群紊乱,激活中枢及外周免疫炎症反应,最终损害认知功能。
这一结论为肠脑轴相关研究提供了重要的理论支持,也为调节睡眠剥夺给身体带来的一系列不良影响提供潜在治疗靶点。
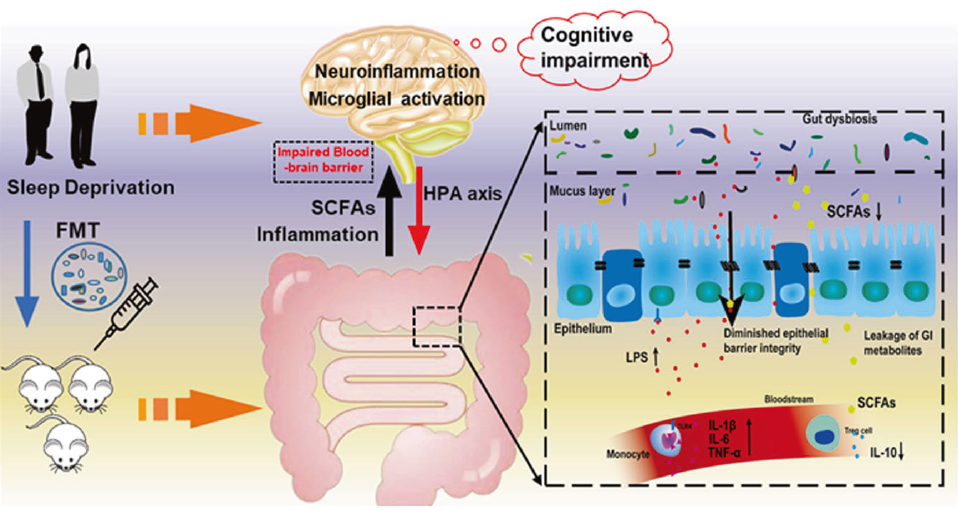
图文摘要:肠道菌群调节睡眠剥夺后的免疫炎症反应,促进SD相关的认知功能受损
不过话说回来,晚睡党们,任何以伤身体为前提的熬夜绝对是不值得熬的夜,还是养成良好的睡眠习惯吧。反正奇点糕已立下flag:今晚绝不熬夜!
参考文献
[1]. Wang Z, Chen WH, Li SX, et al. Gut microbiota modulates the inflammatory response and cognitive impairment induced by sleep deprivation. Mol Psychiatry. 2021;10.1038/s41380-021-01113-1. doi:10.1038/s41380-021-01113-1
[2]. Kreutzmann JC, Havekes R, Abel T, Meerlo P. Sleep deprivation and hippocampal vulnerability: changes in neuronal plasticity, neurogenesis and cognitive function. Neuroscience. 2015;309:173-190. doi:10.1016/j.neuroscience.2015.04.053
[3]. Wang YH, Wang J, Chen SH, et al. Association of Longitudinal Patterns of Habitual Sleep Duration With Risk of Cardiovascular Events and All-Cause Mortality. JAMA Netw Open. 2020;3(5):e205246. Published 2020 May 1. doi:10.1001/jamanetworkopen.2020.5246
[4]. Irwin MR. Sleep and inflammation: partners in sickness and in health. Nat Rev Immunol. 2019;19(11):702-715. doi:10.1038/s41577-019-0190-z
[5]. Pearson-Leary J, Zhao C, Bittinger K, et al. The gut microbiome regulates the increases in depressive-type behaviors and in inflammatory processes in the ventral hippocampus of stress vulnerable rats. Mol Psychiatry. 2020;25(5):1068-1079. doi:10.1038/s41380-019-0380-x
[6]. An Q, Li C, Chen Y, et al. Scaffold hopping of agomelatine leads to enhanced antidepressant effects by modulation of gut microbiota and host immune responses. Pharmacol Biochem Behav. 2020;192:172910. doi:10.1016/j.pbb.2020.172910
[7]. Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell. 2016;165(6):1332-1345. doi:10.1016/j.cell.2016.05.041
[8]. Vinolo MA, Rodrigues HG, Nachbar RT, Curi R. Regulation of inflammation by short chain fatty acids. Nutrients. 2011;3(10):858-876. doi:10.3390/nu3100858
[9]. Li JM, Yu R, Zhang LP, et al. Dietary fructose-induced gut dysbiosis promotes mouse hippocampal neuroinflammation: a benefit of short-chain fatty acids. Microbiome. 2019;7(1):98. Published 2019 Jun 29. doi:10.1186/s40168-019-0713-7
[10]. Benedict C, Vogel H, Jonas W, et al. Gut microbiota and glucometabolic alterations in response to recurrent partial sleep deprivation in normal-weight young individuals. Mol Metab. 2016;5(12):1175-1186. Published 2016 Oct 24. doi:10.1016/j.molmet.2016.10.003
[11]. Irwin MR, Wang M, Ribeiro D, et al. Sleep loss activates cellular inflammatory signaling. Biol Psychiatry. 2008;64(6):538-540. doi:10.1016/j.biopsych.2008.05.004
[12]. Laugerette F, Alligier M, Bastard JP, et al. Overfeeding increases postprandial endotoxemia in men: Inflammatory outcome may depend on LPS transporters LBP and sCD14. Mol Nutr Food Res. 2014;58(7):1513-1518. doi:10.1002/mnfr.201400044
转自:https://mp.weixin.qq.com/s/HDMm4Kr420dWTVwMsqsPmA