文 | 菠萝
“中国特色”癌症的新希望
在刚结束的2020欧洲肿瘤内科学会(ESMO)年会上,多项重磅抗癌新药的研究结果公布。对中国患者而言,意义最重大的成果之一,无疑是免疫肿瘤药物在上消化道肿瘤一线治疗中的突破!
尤其是一项名为CheckMate-649的国际大型研究,纳武利尤单抗(俗称O药)加上化疗的组合,一线治疗HER2阴性的晚期上消化道肿瘤患者(包括胃癌,胃食管结合部癌和食管腺癌),战胜了目前的标准疗法:单独化疗。
对于参与试验的患者,无论总生存期(OS),还是无进展生存期(PFS)都取得了改善。尤其是对PD-L1阳性(CPS分数≥5)的患者,获益最为明显。
O药这项研究的成功,是免疫组合疗法首次在胃癌一线治疗III期研究中,让患者总生存和无进展生存都显著获益。随着这个数据出炉,免疫组合疗法有望取代化疗,成为这些患者一线治疗的新标准!
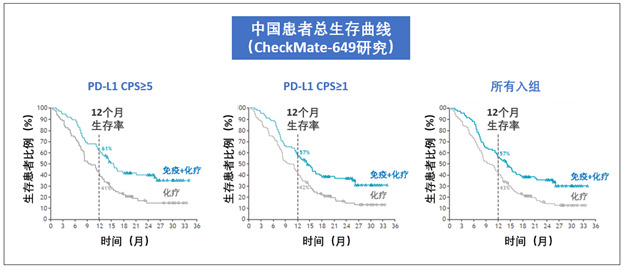
从下图可以看出,PD-L1阳性患者的生存曲线从一开始就分开了,说明O药+化疗的优势是非常明确的。
CheckMate-649研究的结果备受瞩目,除了数据很好之外,还有个重要原因是研究的规模非常大:整个研究包含来自全球多个国家的2000多位患者,其中包括13.4%的中国患者!
CheckMate-649是目前为止开展过的规模最大的胃癌免疫治疗临床研究。
2000多例入组患者是什么概念呢?
一般I期临床试验大概需要20-30名受试者,到了III期临床研究的入组人数在500左右,而通过I期临床的药物仍有非常大的可能无法通过III期临床研究。通常,800-1000例左右的III期试验已经能被称为大型研究,这样超过2000例患者参与的大型抗癌新适应症研究非常少见。
但它的优势是如果成功,结果的可信度会高很多。毕竟参与的患者越多,出现随机偏差的可能性就越小,数据更能代表真实情况,结果的普适性也会更好。尤其是对于胃癌这类异质性很高,患者情况千差万别的癌症类型。
这项研究的成功对于胃癌患者意味着希望,对于中国患者尤其重要!因为全球近半数的胃癌患者都在中国,已成为我国“特色癌种”,形势严峻。
为什么中国胃癌患者这么多呢?其中最重要的一些因素包括:
幸运的是,这些都是可以通过改变生活习惯或者药物治疗改变的。
幽门螺杆菌是胃癌最大的风险因素之一,携带者患癌风险是其它人的3~6倍。中国有一半以上成年人都是幽门螺杆菌携带者。如果有胃癌家族史,杀灭幽门螺杆菌可以大幅降低的胃癌风险。
不健康的生活习惯也会增加胃癌风险。中国很多地区都有腌制的美食,比如我老家四川的香肠腊肉。它们固然是美味,但科学研究发现,长期吃腌制食物会显著增加胃癌风险。世界卫生组织的一级致癌物列表里,赫然有一个就是“中式咸鱼“!
更重要的是,中国的胃癌不仅多,而且由于筛查不足,多数发现就是晚期,生存率很差。目前,中国晚期胃癌的一线治疗药物以化疗为主,但效果并不理想,容易复发耐药。对于晚期患者而言,目前的5年整体生存率通常不足10%。
毫无疑问,我们亟需更好的疗法来帮助胃癌患者。但很遗憾,虽然无数科学家前仆后继,但对于晚期胃癌患者,一线治疗已经10多年没有什么显著突破了。
随着O药这次研究的成功,我们终于看到了曙光。
从三线到一线的跨越
熟悉免疫治疗的读者可能知道,这并不是O药第一次在胃癌中取得成功。就在今年三月,O药已经获得中国药监局批准上市用于治疗胃癌。中国患者盼来了首个获批用于晚期胃癌治疗的免疫肿瘤药物!(扩展阅读:O药再获批,中国首个胃癌免疫疗法来了!)
只不过,当时获批的是三线或以上的晚期患者治疗。也就是针对使用过化疗等药物后效果不好,已经耐药或复发的患者。
一线治疗:肿瘤诊断后首次选择的治疗方案
二线治疗:一线治疗失败后,选择的治疗方案
三线治疗:一线和二线治疗都失败后,选择的治疗方案
为什么当时获批的适应证只有三线呢?
因为第一批参与O药在胃癌中的临床试验患者都是接受过化疗的。数据来自什么患者,就支持什么患者的使用,凭证据说话,这就是现代科学研究的精神。
但大家一直都很好奇,对于刚诊断的晚期胃癌患者,能不能直接一线就用免疫药物或者组合疗法?疗效如何?
这个问题很重要,因为免疫药物早一点用,效果可能更好。(扩展阅读:都在谈免疫治疗,应该把它留到最后才用么?)
理论上讲,由于免疫药物起效的原理是激活患者体内的免疫系统,所以患者状态越好,免疫系统越强,治疗效果就可能越好。很显然,比起已经接受过化疗或其它治疗的人,刚诊断患者的身体状态和免疫系统都应该是更好的。
不仅理论如此,免疫治疗研究很多的肺癌,黑色素瘤等肿瘤类型里的数据,也都支持这一点。免疫疗法用于一线治疗的时候,患者长期生存率看起来更高。
胃癌中是不是也是如此呢?
一直以来,研究的结果都不明朗,专家们并没有达成共识,指南也没有推荐。
这一次,我们终于看到了明确的结论:CheckMate -649研究数据证明,对于特定的晚期胃癌患者,一线直接用免疫+化疗的组合方案,是更好的选择。
不止是CheckMate-649研究,O药在日本和韩国还进行了另一项名为ATTRACTION-4的研究,也取得了积极的数据。
借由这些研究结果,O药巩固了自己在胃癌免疫治疗领域的领先地位。
获益的患者群体
胃癌可以分为很多亚型。CheckMate -649的首轮结果是否能够告诉我们,到底什么样的胃癌患者是免疫组合疗法的优选人群呢?
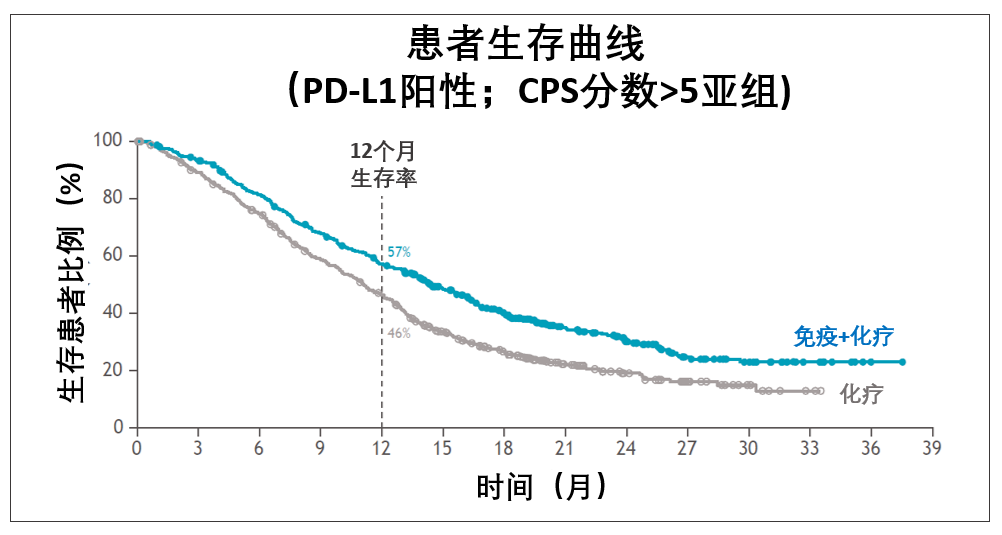
在这次研究中,从O药+化疗的方案中获益最大的是CPS分数≥5的患者。
和化疗相比,这些患者中位生存期从11.1个月提高到14.4个月,死亡风险下降了29%。在一年的时候,化疗组有46%患者生存,免疫+化疗组则是57%。
那啥是CPS分数≥5呢?
所谓的CPS(Combined Positive Score,综合阳性分数),是用来描述肿瘤样本表达PD-L1蛋白水平的一个指标。
简单地说,CPS分数越高,说明肿瘤样本里表达PD-L1的细胞越多。这样的指标,我们称之为“生物标记物”。
之所以把PD-L1表达量作为免疫治疗的“生物标记物”,是因为很多研究都发现,PD-L1表达越多,肿瘤免疫治疗的整体效果响应往往越好。
这次的数据再次证明了这一点。
本次研究的最主要目的,是看PD-L1阳性(CPS分数≥5)患者中的效果。但为了对比,研究中也纳入了很多PD-L1表达弱阳性甚至阴性的患者。
结果看起来,确实是CPS分数越高,PD-L1蛋白表达量越高,免疫组合疗法效果越好。
- 如果不管CPS分数(所有患者),免疫组合疗法让患者整体死亡风险下降了20%;
- 如果只看CPS分数≥1的患者,免疫组合疗法让患者整体死亡风险下降了23%;
- 如果只看CPS分数≥5的患者,免疫组合疗法让患者整体死亡风险下降了29%;
不过,大家肯定会问,PD-L1表达量更低的患者能不能也尝试这个组合疗法呢?
目前来看:有希望,但还要等更多数据。
说有希望,是因为从生存曲线来看,不考虑PD-L1表达,参与研究的患者整体实现了总生存获益。
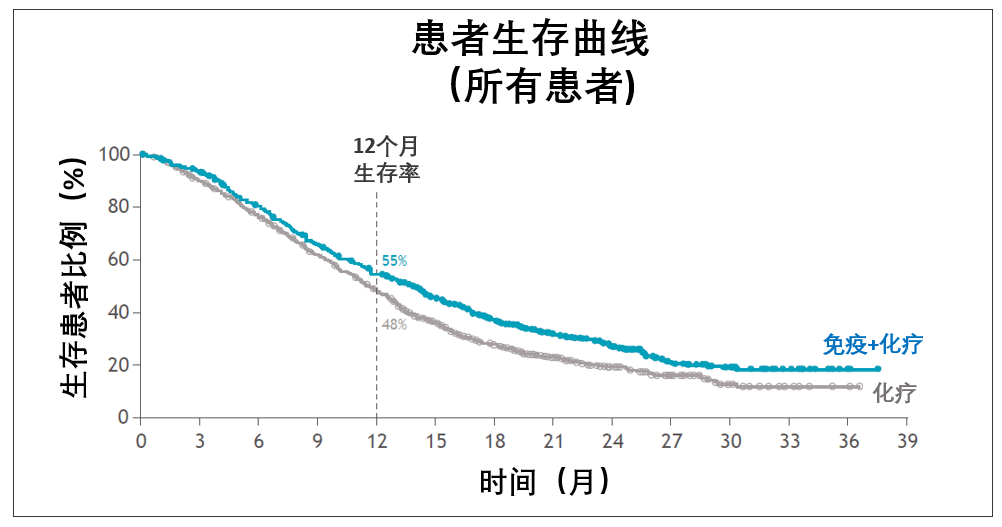
但我们还要等更多数据,因为目前针对PD-L1弱阳性(1≤CPS分数<5)或者PD-L1阴性(CPS分数<1)两个亚组患者的详细数据还有没有披露。
这些数据很关键。如果后续分析证明在这些亚组里,免疫组合疗法也优于化疗,那适用的人群就会大大增加了。
在肺癌中,免疫+化疗的组合用于一线治疗并不需要生物标记物,无论PD-L1表达如何都可能获益。胃癌中是否也是如此?我们拭目以待。
另外,除了PD-L1的表达量,研究者还根据其它特征对患者进行了分组分析,想看看免疫疗法的效果是否有区别。比如,分为男性/女性;亚裔人群/非亚裔人群;肝转移/无肝转移等等。
幸运的是,无论性别如何,种族如何,转移情况如何,患者都可以从免疫疗法中获益,结果都优于化疗。
价值和展望
这次研究最大的意义,是证明了胃癌一线用免疫组合疗法是可行的。
O药是在中国已经获批胃癌三线治疗的免疫药物。如果未来一线再获批,就意味着能惠及更广大的中国患者。
我相信,这只是个开始。随着后续研究的深入,我们还能看到更多让人欣喜的消息,或者找到更好的免疫治疗使用方法。
比如,免疫治疗最大的优势,是疗效的可持续性。根据以往的经验,随着随访时间越来越长,我们有望看到生存曲线的拖尾效应,也就是出现一些长期幸存者。胃癌中会不会出现呢?
再比如,目前看来,“免疫+化疗”的副作用整体可控,但毕竟化疗副作用很明显,而且长期使用会打击免疫系统功能。我们能不能减少化疗次数,既保持化疗药杀伤癌细胞的效果,又降低它对免疫系统的抑制?甚至对于一些患者,能否只用免疫药物?
另外,除了免疫+化疗,目前临床尝试最多的免疫组合疗法还有“免疫+免疫”,“免疫+靶向”。事实上,CheckMate-649研究还有一组没有公布数据的患者,就是尝试了O药联合“伊匹木单抗(俗称Y药)”的双免疫药物组合。
不同免疫药物,不同的组合在胃癌治疗中效果如何,值得期待。
总之,对于胃癌患者而言,现在免疫治疗带来了全新的希望。我们期待后续研究能让胃癌的免疫疗法的使用变得更加精准,更加有效。
这里还要多补充一句,可能有人会问:目前中国上市的PD-1/PD-L1免疫药物已经有好几个了。到底咋选?
简单来说,这些药物并不完全一样,无论药物设计还是临床效果都是有差别的。且尽管免疫药物有泛瘤种治疗的特性,但每个瘤种特征不同,也不能盲目用药。个人意见,大家应该根据临床研究数据来判断,一般情况下,应该选择已经在相应适应证里获批的药物,规范用药。
抗癌领域突飞猛进,不止是免疫治疗,还有很多新疗法值得期待。
比如,这次免疫治疗是针对HER2阴性患者的。而前段时间,针对HER2阳性胃癌的第一个抗体药物偶联药物在日本获批上市,给这部分患者带来了新希望。
另外,2018年来自中国的科学家还公布了针对胃癌的CAR-T细胞治疗早期数据,多位晚期患者肿瘤显著缩小或得到控制。如果该结果能在更多患者中被重复,将是胃癌治疗领域的重大突破。
相信随着更多创新疗法的出现,随着预防和筛查的普及,中国胃癌的生存率会迅速提高。把它变成慢性病,是我们的目标。
致敬生命!
*本文旨在科普癌症新药背后的科学,不是药物宣传资料,更不是治疗方案推荐。如需获得疾病治疗方案指导,请前往正规医院就诊。
参考文献:
[1] Nivolumabplus chemotherapy versus chemotherapy as first line treatment for advancedgastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma:firstresults of the CheckMate 649 study. ESMO 2020
[2] Nivolumabin patients with advanced gastric or gastro-oesophageal junction cancerrefractory to, or intolerant of, at least two previous chemotherapy regimens(ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled,phase 3 trial. Lancet. 2017 Dec 2;390(10111):2461-2471.
[3]A phase 3 study of nivolumab in previously treated advanced gastric orgastroesophageal junction cancer (ATT RAC TION‑2): 2‑year update data. Gastric Cancer2019(19).
[4]https://seer.cancer.gov/statfacts/html/stomach.html
_________
转自:https://mp.weixin.qq.com/s/CmZBpwMH9nDwNUHCq_m5sw